Солі, розчинені у морській воді. У морокій воді розчинено багато різних солей, які надають їй своєрідного гірко-солоного смаку. Солоний смак морської води визначається головним чином розчином хлористого натрію (кухонної солі). Гіркий смак залежить від розчинів солей магнію (MgCl 2 , MgSO 4 ). 1 тис. г(літр) океанічної води в середньому містить 27,2 гхлористого натрію, 3,8 гхлористого магнію, 1,7 гсірчанокислого магнію. Далі йдуть сірчанокислий кальцій (CaSO 4 ) 1,2 г,сірчанокислий калій (K 2 SO 4 ) 0,9 гта інші, зміст яких не перевищує 0,1 м.Таким чином, на 1 тис. гокеанічної води доводиться 35 гсолей.
Як би не була розведена морська вода прісними водами, відсоткове співвідношення солей, що входять до її складу, залишається постійним.
Так:
Крім того, до складу морської води входить ще до 30 різних речовин, але їх кількість так мала, що всі вони разом становлять не більше 0,1%.
Вода океанів і морів, як говорилося, перебуває у безперервному кругообігу. Вона випаровується, падає атмосферними опадами, проходить довгі шляхи підземними та наземними водами і знову повертається до океану. Проходячи ці довгі шляхи, вода розчиняє багато різних речовин і приносить їх у Світовий океан. Таким чином, Світовий океан є ніби місцем накопичення тих розчинних речовин, які постійно приносяться туди річками та річками. Однак, якщо порівняти хімічний склад розчинів, що містяться в морській та прісній воді, то ми помітимо велику різницю.
У морській воді переважають хлористі солі, а в річковій, навпаки, їх дуже мало. У річковій воді дуже багато вуглекислих солей (вуглекислого кальцію), тоді як у морській воді їх дуже мало. Останнє пояснюється тим, що вуглекислий кальцій, кремній та інші речовини в морях у величезній кількості витрачаються тваринами та рослинними організмами на створення різноманітних скелетних утворень, раковин, коралових будівель і т. д. Після смерті цих організмів їх скелети та раковини падають на дно, утворюючи там величезні товщі відкладень. Взагалі слід зазначити, що співвідношення солей у морській воді постійно регулюється органічним життям моря.
Солоність. На 1 л ( 1 тис. г)морокої води, як уже говорилося, в середньому припадає близько 35 гсолей. Інакше кажучи: на 1 тис. вагових частин морокої води припадає 35 вагових частин солей. Число 35 у цьому випадку позначає солоністьморської води, виражену у тисячних частках. Символічно солоність позначається так: S=35°/оо, тобто солоність (S) = 35 проміле.
Вода океанів, взята далеко від берегів, має зазвичай солоність (S) = 35 ° /oo. Вода ж прибережних частин, опріснена річками, має солоність 34-33 і навіть 32%. У поясах пасатних вітрів, де дощі падають рідко, а випаровування велике, солоність підвищується до 36 і навіть 37%.
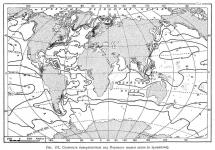
У Північному Льодовитому океані, навпаки, у зв'язку з малою випаровуваністю солоність лежить на поверхні знижується до 34%о. Знижена солоність спостерігається також у екваторіальному поясі, де випадає дуже багато опадів (рис.157).
На глибині понад 1000-1500 мсолоність у всіх океанах 35% 0 .
Дещо інакше справа з морями. Крайові моря, з'єднані з океанами широкою протокою або великою кількістю проток, мають досить високу солоність. Так, наприклад, у Японському морі вона виражається в ЗЗ 0/00 в Охотському – 32°/оо. Віддалені від океанів внутрішньоматерикові моря, в які вливається багато великих річок, мають слабку солоність. Так, наприклад, солоність Чорного моря 14-19 ° / О, Балтійського 8-12% 0, а в північній частині Ботнічної затоки навіть 3 ° / 00 . Навпаки, моря, оточені областями із сухим кліматом, мають підвищену солоність. Так, Середземне море має солоність 38-39 ° / оо, а Червоне море, оточене пустель, має солоність близько 41% 0 .
Вивчення солоності має значення як у науці, і у практичному житті. Точне знання солоності дає можливість визначати течії та взагалі рух водних мас як у горизонтальному, так і вертикальному напрямку. Велике значення солоність та питома вага морських вод має у оборонній справі. Плавання підводних човнів, глибина і швидкість занурення, мінування вод, торпедування ворожих суден тощо вимагають точних знань про солоність і течії в тій чи іншій ділянці моря.
Колір. Чисте шибку нам здається абсолютно прозорим. Але якщо покласти два-три десятки чистого прозорого скла в стопку, то виявиться, що стопка стала напівпрозорою і насилу пропускає блакитне або злегка зелене світло. Значить, чисте прозоре скло все ж таки не цілком прозоре і не безбарвне.
Приблизно те саме доводиться сказати і про воду. Чиста дистильована вода здається безбарвною і прозорою. Однак це спостерігається лише у тому випадку, якщо шар води порівняно тонкий. У товстішому шарі вода здається блакитною. Цей блакитний колір легко помітити у білій ванні, наповненій чистою прозорою водою.
Для точного визначення кольору чистої води брали скляну трубку 5 мдовжини і, наповнивши її дистильованою водою, закривали обидва кінці трубки плоским склом. Трубку поміщали у світлонепроникний футляр. Встановивши один кінець трубки у вікно, дивилися в інший кінець світла. Виявилося, що чиста вода, що дистилює, має чудовий ніжний і чистий блакитний колір. Це означає, що вода поглинає червоні та жовті промені спектру та добре пропускає блакитні.

Знаючи, що чиста вода має блакитний колір, ми легко зрозуміємо, чому чиста вода озер, морів та океанів має блакитний колір. Будь-яка домішка до води змінює забарвлення. Так, наприклад, якщо до чистої води додати найтонший порошок жовтого або червоного кольору, то вода набуває зеленого відтінку і т. д. Останнє добре видно на морі біля берегів після сильних прибоїв: змучена вода біля берегів набуває зеленуватого забарвлення.
Солі, розчинені в морській воді, на колір води не впливають, внаслідок чого вода морів має переважне блакитне забарвлення. Однак домішки зважених частинок мулу відразу ж надають воді того чи іншого відтінку. Так, наприклад, нар. Хуанхе (Жовта), що протікає через лісові області Китаю, забарвлює морську воду жовтуватий колір (Жовте море). Домішка мулистих частинок, що приносяться річками, надає воді Білого моря зеленого кольору, а водам Балтійського моря - каламутно-зелений відтінок.
Прозорість. Домішки різних речовин не тільки змінюють колір, але змінюють і ступінь прозорості води. Кожному відомо, що каламутні води найменш прозорі, а чиста вода відрізняється найбільшою прозорістю. В науці та практичному житті (особливо в оборонній справі) вивчення кольору та прозорості води має велике значення. Для вивчення ступеня прозорості води використовується дуже простий прилад - диск Секкі. Він складається з цинкового диска, що має 30 сму діаметрі, пофарбованого в білий колір. Диск на кшталт чашки звичайних ваг привішується до шнура і повільно занурюється у воду. При цьому зверху стежать, на якій глибині білий диск перестає бути видимим. Ця глибина визначає ступінь прозорості води у басейні. Так, наприклад, у Білому морі диск стає невидимим на глибині 6-8 м,у Балтійському 11 -13 м,у Чорному 28 м.Найбільшою прозорістю відрізняються води Середземного моря – до 50-60 м.Великою прозорістю відрізняються також води Тихого океану. м)і особливо Саргасового моря (66 м).
При визначенні прозорості зазвичай визначають колір. Білий диск у міру занурення змінює колір. В одних басейнах диск на певній глибині набуває блакитного кольору, в інших зелений і т.д.
Для точності позначення спостережуваного кольору використовується шкала, що складається з низки трубочок, заповнених розчинами різних відтінків від блакитного до жовтого кольору.
Світіння моря. У нічний час часто спостерігається світіння морської води. Останнє походить не від самої води, а від деяких організмів, що мешкають у морській воді, здатних випромінювати світло. До таких організмів відносяться: бактерії, що світяться, одноклітинні (особливо нічосвітня, які у великій кількості з'являються в кінці літа), деякі медузи та ін.
Температура морської води. Вода - найтепліше тіло на Землі. Щоб нагріти 1 см 3води на 1 0 потрібно витратити тепла стільки ж, скільки потрібно його на нагрівання 5 см 3на той же 1° граніту або 3134 см 3повітря. Це означає, що теплоємність води в п'ять разів більша за теплоємність граніту і в 3 тис. з лишком разів більша за теплоємність повітря.
Поверхня океанів і морів становить понад 2/3 поверхні земної кулі. Отже, понад 2/3 сонячної енергії, що поглинається поверхнею земної кулі, посідає Світовий океан. Частина цього тепла витрачається на випаровування, частина на нагрівання повітря над морем, частина, відбиваючись, випромінюється в небесний простір і частина йде на нагрівання водної поверхні. У результаті, за приблизними підрахунками, з усієї кількості сонячного тепла, що падає на одиницю поверхні водного басейну, у тропічному поясі на нагрівання йде 60%, у помірних близько 30% та в холодних до 10%.
Роль цього тепла у житті атмосфери та життя материкових вод нами вже зазначалося. Йшлося також і про те, що добові та річні коливання температури водної поверхні зовсім інші в порівнянні
із сушею. Нагадаємо лише, що добова амплітуда поверхні океану в тропічному поясі виражається в 0,5-1°, в помірному поясі близько 0°,4 і холодному близько 0°,1. Що ж до річної амплітуди, то вона також дуже невелика: у спекотному поясі 2-3°, в помірному від 5 до 10° та холодному 1-2°. Відзначивши ці особливості у нагріванні водної поверхні, перейдемо тепер до температур океанів та морів.
Вимірювання температур морів та океанів. Вимірювання температури поверхневих шарів не становить жодних труднощів. Беруть цебро води, опускають у цебро термометр, який і покаже температуру. Що ж стосується глибших шарів води і особливо вимірювання температури на глибинах, то тут доводиться застосовувати термометри особливого пристрою, звані глибинними термометрами(Рис. 158).
Глибинний термометр насамперед має протистояти силі того величезного тиску, що існує на глибинах. Це досягається, по-перше, тим, що термометр полягає в трубку з товстого скла, а потім у мідну гільзу таким чином, щоб вода торкалася товстостінної скляної трубки термометра лише біля ртутної кульки. Крім того, глибинний термометр повинен фіксувати ту температуру, яка відзначена ним на глибині. Останнє досягається тим, що в потрібний момент, по даному сигналу зверху, термометр швидко повертається верхом вниз. При цьому стовпчик ртуті в термометрі розривається, що дозволяє фіксувати показання термометра.
Температура поверхні океанів та морів. Корабчи, які плавають різними морями і океанами, щодня, разом із визначенням географічних координат, визначають і температуру води лежить на поверхні моря. На підставі подібних численних спостережень складаються карти середніх місячних та річних температур поверхні Світового океану та наносяться відповідні ізотерми (рис. 159). По картах ізотерм видно, що температура поверхні океанів у спекотному поясі підвищується на захід, а помірному на схід. Останнє залежить, як побачимо далі, від морських течій, які у тропічному поясі прямують переважно захід, а помірному відхиляються на схід.
Порівнюючи самі середні річні температури повітря над сушею і над океанами, бачимо, що у спекотному поясі середня річна температура суші трохи вище, ніж над морем. У помірному та холодному поясах, навпаки, температура над морем значно вища, ніж над сушею. Цей помірний і зігріваючий вплив моря ми свого часу вже відзначали.
Температури на глибині. Безпосередні виміри показали, що добові коливання, щоправда, дуже мізерні, можна побачити до глибини 25-30 м,річні ж до 200-300 м,а в деяких випадках навіть до 350 м.Глибше 300-350 мтемпература залишається незмінною у всі пори року. Інакше висловлюючись, на глибині 300-350 мми маємо шар постійної температури. Однак із глибиною температура продовжує поступово знижуватися (на кожні 1 тис. мглибини приблизно на 1-2 °), і на глибині 3-4 тис. мвона сягає 2° і навіть до - 1°. Це

поступове зниження температури з глибиною пояснюється тим, що холодна вода, маючи велику щільність, занурюється вниз, а тепла вода, як легша, зосереджується у верхніх шарах. На відміну від прісної води морська вода набуває найбільшої щільності не при 4 ° С, а при 2 ° і нижче, що знову-таки залежить від ступеня її солоності. Низька температура глибин всіх океанів пояснюється впливом полярних морів та океанів. Там вода, охолоджуючись до - 1 і - 2 °, опускається і повільно розтікається дном всіх океанів. Відбувається, щоправда, дуже повільний, але постійний рух води в придонних частинах від полюсів до екватора і верхніх частинах від екватора до полюсів (рис. 160). Наявність подібного руху робить зрозумілим, чому придонні температури південних частин океанів нижче за ті самі придонні температури північних частин океанів. Підводний поріг (Томсона) в Атлантичному океані перегороджує шлях холодним придонним водам Північного Льодовитого океану, внаслідок чого в північній частині Атлантичного океану придонна температура 3°,5 і 4°, а за порогом Томсона, в Північному Льодовитому океані, вона відразу ж падає до -1 °,2.
Відсутність подібних порогів у південній частині Атлантичного океану призводить до зворотних результатів. Там уже з 50° пд. ш. придонна температура нижче 0°.
Ще різкіше відокремлена північна частина Тихого океану від Північного Льодовитого океану, що призводить до зниження температур на південь.

Замерзання морської води. Процес замерзання морської води протікає значно складніше проти прісної. Прісна вода за звичайних умов замерзає при 0°, а морська - за нижчих температур. Температура замерзання морської води залежить насамперед від ступеня її солоності, що добре можна побачити з наведеної таблиці:

Прісна вода найбільшу щільність має за 4°С. Що ж до морської води, то вона найбільшої щільності досягає за більш низьких температур, знову-таки залежно від ступеня солоності. Так наприклад:
Вода прісноводних басейнів при охолодженні з поверхні стає важчою і занурюється вниз, а на її місце з глибини піднімається легша тепла вода. Це своєрідний рух (званий конвекцією)поступово захоплює все більші та більші товщі води. Коли ж, нарешті, вся маса води охолоджується до 4°С, т. е. досягне своєї максимальної щільності, конвекція припиняється, оскільки вода лежить на поверхні басейну, охолоджуючись далі, стає легше. За умов, що створилися, поверхневий шар далі охолоджується дуже швидко і швидко замерзає. У морській воді конвекція не припиняється, тому що щільність води зі зниженням температури постійно зростає. Крім того, при замерзанні морської води кристалики льоду утворюються з чистої (прісної) води, причому сіль виділяється та підвищує солоність незамерзлої води. З підвищенням солоності температура замерзання і температура максимальної щільності, як це видно з наведених вище таблиць, значно знижується. Все це разом узяте сильно уповільнює процес замерзання. Таким чином, для замерзання морської води потрібні нижчі температури та більша тривалість часу. Рясне випадання снігу (що опріснює поверхню морської води) прискорює замерзання. Хвилювання, навпаки, уповільнює замерзання.
При замерзанні прісних вод ми розрізняли три моменти: утворення сала, утворення млинця і, нарешті, повне замерзання всієї поверхні. Приблизно так само протікає замерзання моря. Кристали в морській воді утворюються більші і зростаються більшими грудками і крижинками, які майже покривають море. Останнє надає морю своєрідного матового відтінку. Цей початковий період замерзання моря відомий у моряків під назвою крижаного сала.

Далі крижини збільшуються в розмірах, труться один про одного і набувають вигляду великих плаваючих тарілок більш-менш округлої форми. Цей своєрідний, поки що не суцільний рухливий крижаний покрив називають млинчастим льодом.
Якщо погода стоїть тиха і хвилювання на морі слабке, то окремі млинці змерзаються, внаслідок чого утворюється суцільний крижаний покрив, товщина якого поступово збільшується. Сильне хвилювання зазвичай розбиває крижаний покрив на величезні плоскі крижані шматки, які називаються крижаними полями.Крижані поля під впливом вітрів насуваються один на одного, зламуються по краях, нагромаджуючи купи та вали уламків, відомих під назвою крижаних торосів(Рис. 161).
Висота торосів над поверхнею крижаного поля зазвичай не перевищує 5 м,але в окремих випадках доходить до 9 м.Ця підводна маса льоду утримується великим скупченням льоду під торосом. Товщина крижаних мас під торосом зазвичай перевищує висоту торосу вдвічі-втричі, так що загальна товщина тороса доходить до 15-20 м.
Торосисті льоди легко застряють на мілинах і утворюють біля берегів скупчення рухомих льодів, відомих під назвою берегового припаю.Найбільших розмірів береговий припай досягає у східних берегів Таймиру і особливо біля Новосибірських островів та о. Врангеля (300-400) кмширини). Тороси, що окремо сидять на мілинах, називають стамухами.
Крижані поля, що знаходяться в межах Північного Льодовитого океану, не встигають розтаювати протягом короткого та прохолодного літа. Наступної зими товщина льоду збільшується. Виходить товстіший дворічний лід. Потовщення льоду продовжується і в наступні роки. В результаті утворюється товстий і дуже міцний лід до 5 і більше метрів. Великі скупчення багаторічного льоду, що рухається, відомі під назвою полярний пакет.Полярний пак займає більшу частину поверхні Північного Льодовитого океану.
Ми вже говорили про те, що крижані поля Північного Льодовитого океану за літо не можуть розтанути. Якби в Північний Льодовитий океан не вливалися теплі води Атлантичного океану (течі Гольфстрім) і холодна Гренландська течія не виносила полярні льоди в Атлантичний океан, то весь Північний Льодовитий океан перетворився б на суцільну крижану пустелю. Цілком можливо, що відсутність проходу між Атлантичним і Північним Льодовитим океанами і була однією з

Найголовніших причин тих льодовикових періодів, які пережила Євразія та Північна Америка у четвертинний час. Вплив течій на замерзання Світового океану добре видно на прикладеній кліматичній карті.
Айсберг. Материк Антарктида, о. Гренландія та багато інших островів Північного Льодовитого океану, як ми вже знаємо, мають потужні товщі материкового льоду. Материкові льоди, сповзаючи в море, дають початок численним плаваючим горам, або айсбергам. За приблизними підрахунками в одне лише Баффінове море із західних берегів Гренландії щорічно надходить понад 7 тис. айсбергів.
Питома вага льоду близько 0,9, тоді як питома вага морської води трохи більше 1,0. За цих умов крижані гори виявляються зануреними у воду на 6 / 7 свого обсягу. Таким чином, над водою піднімається всього 1/5 - 1 / 7 частина крижини.
Наскільки великі можуть бути льодові гори Антарктиди, що плавають, можна бачити з наступних прикладів. Материкові льоди Антарктики сповзають величезними масами, утворюючи крижані стіни, що піднімаються над рівнем моря на 30-40 і більше метрів. Крижана стіна «Великого бар'єру» (рис. 162), що прямовисно падає в море, тягнеться протягом 750 км.Над водою вона піднімається на 30-40, а подекуди на 70 м.Середня товщина льоду тут не менше 180-200 м.Зрозуміло, що уламки такого льодовика можуть досягати величезних розмірів і мають форму. У 1854 р. у південній частині Атлантичного океану ряд кораблів у своїх суднових журналах відзначив зустріч із крижаною горою, довжина якої була понад 100 км,а висота над водою 90 м.У 1911 р. на південь від Австралії була зустрінута крижана гора. кмдовжини. Крижані гори меншого розміру зустрічаються значно частіше. Так, наприклад, наша експедиція під керівництвом Беллінсгаузена у 1819 р. зустріла біля берегів Антарктиди до 250 крижаних гір. Іноді судам доводиться йти серед крижаних гір упродовж 400-500 км.

Айсберги виносяться течіями, іноді дуже далеко за межі полярного кола. Так плаваючі крижані гори біля берегів Північної Америки заходять значно на південь від о. Ньюфаундленд і створює велику загрозу кораблям. У південній частині океану айсберги заходять ще далі. В окремих випадках вони досягали 30 і навіть 25 ° пд. ш., тобто майже меж тропічного пояса.
- Джерело-
Половінкін, А.А. Основи загального землезнавства/А.А. - М.: Державне навчально-педагогічне видавництво міністерства освіти РРФСР, 1958. - 482 с.
Post Views: 981
Морська вода замерзає за температур нижче нуля градусів. Чим більша солоність морської води, тим нижча температура її замерзання. Це можна побачити з наступної таблиці:
| Солоність у °/ 00 |
Температура замерзання |
Солоність у °/ 00 | Температура замерзання (у градусах) |
| 0 (Прісна вода) | 0 | 20 | -1,1 |
| 2 | -0,1 | 22 | -1,2 |
| 4 | -0,2 | 24 | -1,3 |
| 6 | -0,3 | 26 | -1,4 |
| 8 | -0,4 | 28 | -1,5 |
| 10 | -0,5 | 30 | -1,6 |
| 12 | -0,6 | 32 | -1,7 |
| 14 | -0,8 | 35 | -1,9 |
| 16 | -0,9 | 37 | -2,0 |
| 18 | -1,0 | 39 | -2,1 |
Ця таблиця показує, що збільшення солоності на 2 ° / 00 знижує температуру замерзання приблизно одну десяту градуса.
Для того щоб почала замерзати вода з океанічною солоністю 35°/00, її потрібно охолодити нижче за нуль майже на два градуси.
Випадаючи на незамерзлу прісну річкову воду, звичайний сніг із температурою танення, що дорівнює нулю градусів, як правило, тане. Якщо ж цей сніг випадає на незамерзлу морську воду з температурою -1°, то він не тане.
Знаючи солоність води, можна визначити температуру замерзання будь-якого моря, користуючись наведеною вище таблицею.
Солоність води Азовського моря взимку близько 12°/00; отже, вода починає замерзати лише за температури 0°,6 нижче нуля.
У відкритій частині Білого моря солоність сягає 25 ° / 00 . Отже, для замерзання вода повинна охолодитись нижче мінус 1°,4.
Вода із солоністю 100°/00 (таку солоність можна зустріти в Сивашах, відокремлених від Азовського моря Арабатською стрілкою) замерзатиме при температурі мінус 6°,1, а в Кара-Богаз-Голі солоність більше 250°/00, і вода замерзає тільки тоді, коли її температура опускається значно нижче 10 ° морозу!
Коли солона морська вода охолоджується до відповідної температури замерзання, у ній починають з'являтися первинні крижані кристали, що мають форму дуже тонких шестигранних призм, схожих на голки.
Тому їх зазвичай називають крижаними голками. Первинні крижані кристали, що утворюються в морській воді, не містять солі, вона залишається в розчині, збільшуючи його солоність. У цьому легко переконатись. Зібравши крижані голки сачком з дуже тонкої марлі або тюлю, треба обполоснути їх прісною водою, щоб змити солону воду, а потім розтопити в іншому посуді. Вийде прісна вода.
Лід, як відомо, легший за воду, тому крижані голки спливають. Їх скупчення на поверхні води нагадують на вигляд плями жиру на остиглим супі. Ці скупчення так і називаються салом.
Якщо мороз посилюється і поверхня моря швидко втрачає тепло, то сало починає змерзати і за тихої погоди виникає рівна, гладка, прозора крижана кірка, яку помори, жителі нашого північного узбережжя, називають нілас. Він такий чистий і прозорий, що в хатинах, зроблених зі снігу, його можна вживати замість скла (звісно, якщо всередині такої хатини немає опалення). Якщо розтопити нілас, вода виявиться солоною. Щоправда, солоність її буде нижчою, ніж води, з якої утворилися крижані голки.

Окремі крижані голки не містять солі, а в морському льоді, що утворився з них, з'являється сіль. Це тому, що безладно розташовані крижані голки, змерзаючись, захоплюють дрібні крапельки солоної морської води. Таким чином, у морському льоду сіль розподіляється нерівномірно – окремими включеннями.
Солоність морського льоду залежить від температури, за якої він утворився. При невеликому морозі крижані голки змерзають повільно і захоплюють мало солоної води. При сильному морозі крижані голки змерзають набагато швидше і захоплюють багато солоної води. У цьому випадку морський лід виявиться солонішим.
Коли морський лід починає танути, то з нього насамперед виховують солоні включення. Тому старий, багаторічний полярний лід, який кілька разів «перелітав», стає прісним. Полярні зимівники використовують для питної води зазвичай сніг, а коли його немає, то старий морський лід.
Якщо під час утворення льоду йде сніг, то він, не розтаюючи, залишається на поверхні морської води, просочується нею і, змерзаючи, утворює каламутну, білувату, непрозору нерівну кригу - молодик. І нілас і молодик при вітрі та хвилюванні розламуються на шматки, які, стикаючись один з одним, оббивають кути і поступово перетворюються на круглі крижини – млинці. Коли хвилювання слабшає, млинці змерзають, утворюючи суцільний млинцевий лід.
Біля берегів, на мілинах, морська вода остигає швидше, тому крига з'являється раніше, ніж у відкритому морі. Зазвичай крига примерзає до берегів, це припай. Якщо морози супроводжуються тихою погодою, припай швидко росте, іноді досягаючи ширини багатьох десятків кілометрів. Але сильні вітри та хвилювання розламують припай. Частини, що відірвалися від нього, спливають за течією, несуть вітром. Так з'являються плавучі льоди. Залежно від розмірів вони мають різні назви.

Крижаним полем називаються плавучі льоди площею більше однієї квадратної морської милі.
Уламками крижаного поля називають плавучі льоди довжиною більше одного кабельтова.
Крупнобитий лід коротший від одного кабельтова, але більше однієї десятої кабельтова (18,5 м). Дрібнобитий лід не перевищує однієї десятої кабельтова, а крижана каша складається з дрібних шматків, що перекидаються на хвилях.
Течії та вітер можуть притиснути плавучі крижини до припаю або один до одного. Тиск крижаних полів один на одного викликає подрібнення плавучих льодів. При цьому зазвичай створюються нагромадження дрібнобитого льоду.
Коли одиночна крижина стає дибки і в такому положенні вмерзає в навколишній лід, вона утворює ропак. Ропаки, засипані снігом, погано видно з літака і під час посадки можуть бути причиною катастрофи.
Часто при тиску крижаних полів утворюються крижані вали – тороси. Іноді тороси досягають висоти кілька десятків метрів. Торосистий лід важко проходимо, особливо для собачих упряжок. Він є серйозною перешкодою навіть для потужних криголамів.

Уламок тороса, що підноситься над поверхнею води і легко відноситься вітром, називається несяком. Несяк, що сів на мілину, називають стамухою.
Навколо Антарктиди та в Північному Льодовитому океані зустрічаються крижані гори – айсберги. Це зазвичай уламки материкового льоду.
В Антарктиді, як це нещодавно встановили дослідники, айсберги утворюються і в морі, на материковій мілини. Над поверхнею води видно лише частину айсберга. Велика його частка (близько 7/8) знаходиться під водою. Площа підводної частини айсберга завжди набагато більша, ніж надводна. Тому айсберги є небезпечними для кораблів.
Тепер айсберги легко виявляються вдалині та в тумані за допомогою точних радіоприладів на кораблі. Раніше були випадки зіткнень кораблів з айсбергами. Так загинув, наприклад, 1912 р. величезний океанський пасажирський пароплав «Титанік».
КРУГОВОРОТ ВОДИ У СВІТОВОМУ ОКЕАНІ
У приполярних зонах вода, остигаючи, стає щільнішою і опускається на дно. Звідти вона повільно сповзає до екватора. Тому на всіх широтах глибинні холодні води. Навіть у екватора придонні води мають температуру лише 1-2° вище за нуль.
Так як від екватора течії забирають теплу воду в помірні широти, то на її місце з глибини дуже повільно піднімається холодна вода. На поверхні вона знову прогрівається, йде в приполярні зони, де остигає, опускається на дно і дном знову переміщається до екватора.
Таким чином, в океанах існує своєрідний кругообіг води: по поверхні вода рухається від екватора до приполярних зон і по дну океанів - з приполярних зон до екватора. Цей процес перемішування води поряд з іншими явищами, про які йшлося вище, створює єдність Світового океану.
Вода в морях та океанах дуже сильно відрізняється від річкової та озерної. Вона солона – і це визначає багато її властивостей. Від цього чинника залежить температура замерзання морської води. Вона не дорівнює 0 °C, як у випадку з прісною водою. Щоб покритися льодом, морю потрібен мороз міцніший.
Сказати однозначно, за якої температури замерзає морська вода, неможливо, оскільки цей показник залежить від ступеня її солоності. У різних місцях Світового океану вона різна.
Найсолоніше – Червоне море. Тут концентрація солі у воді досягає 41 ‰ (проміле). Найменше солі у водах Балтійської затоки – 5‰. У Чорному морі цей показник дорівнює 18 ‰, а в Середземному – 26 ‰. Солоність Азовського моря - 12 ‰. А якщо брати в середньому, солоність морів становить 34,7 ‰.
Чим вище солоність, тим більше повинна охолоне морська вода для переходу в твердий стан.
Це добре видно з таблиці:
| Солоність, ‰ | Температура замерзання, °C | Солоність, ‰ | Температура замерзання, °C |
|---|---|---|---|
| 0 (Прісна вода) | 20 | -1,1 | |
| 2 | -0,1 | 22 | -1,2 |
| 4 | -0,2 | 24 | -1,3 |
| 6 | -0,3 | 26 | -1,4 |
| 8 | -0,4 | 28 | -1,5 |
| 10 | -0,5 | 30 | -1,6 |
| 12 | -0,6 | 32 | -1,7 |
| 14 | -0,8 | 35 | -1,9 |
| 16 | -0,9 | 37 | -2,0 |
| 18 | -1,0 | 39 | -2,1 |
Там, де солоність ще вища, як, наприклад, в озері Сиваш (100 ‰), затоці Кара-Богаз-Гол (250 ‰), у Мертвому морі (понад 270 ‰), вода може замерзнути лише за дуже великого мінусу – у першому у разі – при -6,1 °C, у другому – нижче -10 °C.
За середній показник для всіх морів можна прийняти -1,9 °C.
Етапи замерзання
Дуже цікаво спостерігати, як замерзає морська вода. Вона не покривається відразу рівномірною крижаною кіркою, як прісна. Коли частина її перетворюється на лід (а він прісний), решта об'єму стає ще більш солоним, і для його замерзання потрібно ще міцніший мороз.
Види льоду
У міру охолодження у морі утворюється лід різних видів:
- сніжура;
- шуга;
- голки;
- сало;
- нілас.
Якщо море ще не замерзло, але дуже близько до цього, і в цей час випадає сніг, він при зіткненні з поверхнею не тане, а просочується водою і утворює в'язку кашоподібну масу, що називається сніжурою. Змерзаючись, ця каша перетворюється на шугу, яка дуже небезпечна для кораблів, що потрапили у шторм. Через неї палуба миттєво покривається крижаною кіркою.
Коли стовпчик термометра досягає потрібної для замерзання позначки, у морі починають утворюватися крижані голки – кристали у вигляді дуже тонких шестигранних призм. Зібравши їх сачком, змивши з них сіль і розтопивши, ви виявите, що вони прісні.
Спочатку голки ростуть горизонтально, потім вони приймають вертикальне положення, і поверхні видно лише їх підстави. Вони нагадують плями жиру в остиглий суп. Тому кригу на цій стадії називають салом.
Коли ще більше холодає, сало починає змерзати і утворює крижану кірку, таку ж прозору і тендітну, як скло. Такий лід називають нілас, або склянка. Він солоний, хоч і утворений із прісних голок. Справа в тому, що під час змерзання голки захоплюють дрібні краплі оточуючої солоної води.
Тільки морях спостерігається таке явище, як плавучі льоди. Виникає воно тому, що вода тут швидше остигає біля берегів. Лід, що там утворюється, примерзає до берегової кромки, чому й отримав назву припай. У міру посилення морозів під час тихої погоди він швидко захоплює нові території, досягаючи часом десятків кілометрів завширшки. Але варто піднятися на сильний вітер – і припай починає розламуватися на шматки різної величини. Ці крижини, часто величезних розмірів (крижані поля), розносяться вітром і течією по всьому морю, створюючи проблеми судам.
Температура танення
Тане морський лід не за тієї ж температури, за якої замерзає морська вода, як можна було б подумати. Він менш солоний (в середньому в 4 рази), тому його перетворення назад на рідину починається раніше досягнення цієї позначки. Якщо середній показник замерзання морської води – -1,9 °C, то середнє значення температури танення льоду, що утворився з неї, – -2,3 °C.
Замерзання солоної води: Відео
У таблиці представлені теплофізичні властивості розчину хлористого кальцію CaCl 2 залежно від температури та концентрації солі: питома теплоємність розчину, теплопровідність, в'язкість водних розчинів, їх температура та число Прандтля. Концентрація солі CaCl 2 у розчині від 9,4 до 29,9%. Температура, при якій наведені властивості, визначається вмістом солі в розчині і знаходиться в діапазоні від -55 до 20°С.
Хлориду кальцію CaCl 2 може не замерзати до температури мінус 55°С. Для досягнення цього ефекту концентрація солі в розчині має бути 29,9%, а його густина складе величину 1286 кг/м 3 .
При збільшенні концентрації солі у розчині збільшується як його щільність, а й такі теплофізичні властивості, як динамічна і кінематична в'язкість водних розчинів, і навіть число Прандтля. Наприклад, динамічна в'язкість розчину CaCl 2з концентрацією солі 9,4% при температурі 20°С дорівнює 0,001236 Па·с, а зі збільшенням концентрації хлориду кальцію в розчині до 30% його динамічна в'язкість збільшується до значення 0,003511 Па·с.
Слід зазначити, що на в'язкість водних розчинів цієї солі найбільше впливає температура. При охолодженні розчину кальцію хлориду з 20 до -55°С його динамічна в'язкість може збільшитися в 18 разів, а кінематична - в 25 разів.
Дані наступні теплофізичні властивості розчину CaCl 2:
- , кг/м3;
- температура замерзання °З;
- динамічна в'язкість водних розчинів, Па·с;
- число Прандтля.
Щільність розчину кальцію хлористого CaCl 2 в залежності від температури
У таблиці наведено значення щільності розчину хлористого кальцію CaCl 2 різної концентрації в залежності від температури.
Концентрація хлориду кальцію CaCl 2 у розчині від 15 до 30% при температурі від -30 до 15°С. Щільність водного розчину хлористого кальцію збільшується при зниженні температури розчину та збільшенням у ньому концентрації солі.
Теплопровідність розчину CaCl 2 в залежності від температури
У таблиці подано значення теплопровідності розчину хлористого кальцію CaCl 2 різної концентрації при негативних температурах.
Концентрація солі CaCl 2 розчині від 0,1 до 37,3 % при температурі від -20 до 0°С. У міру зростання концентрації солі у розчині його теплопровідність знижується.
Теплоємність розчину CaCl 2 за 0°С
У таблиці подано значення масової теплоємності розчину хлористого кальцію CaCl 2 різної концентрації при 0°С. Концентрація солі CaCl 2 у розчині від 0,1 до 37,3%. Слід зазначити, що з підвищенням концентрації солі в розчині його теплоємність знижується.
Температура замерзання розчинів солей NaCl та CaCl 2
У таблиці наведено температуру замерзання розчинів солей хлористого натрію NaCl та кальцію CaCl 2 залежно від концентрації солі. Концентрація солі у розчині від 0,1 до 37,3 %. Температура замерзання сольового розчину визначається концентрацією соліу розчині та для хлориду натрію NaCl може досягати значення мінус 21,2°С для евтектичного розчину.
Необхідно відмітити, що розчин хлористого натрію може не замерзати до температури мінус 21,2°С, а розчин хлористого кальцію не замерзає при температурі до мінус 55°С.
Щільність розчину NaCl в залежності від температури
У таблиці представлені значення густини розчину хлористого натрію NaCl різної концентрації в залежності від температури.
Концентрація солі NaCl у розчині від 10 до 25%. Значення густини розчину вказані при температурі від -15 до 15°С.
Теплопровідність розчину NaCl залежно від температури
У таблиці наведено значення теплопровідності розчину хлористого натрію NaCl різної концентрації при негативних температурах.
Концентрація солі NaCl у розчині від 0,1 до 26,3 % за температури від -15 до 0°С. За даними таблиці видно, що теплопровідність водного розчину хлориду натрію знижується зі зростанням концентрації солі в розчині.
Питома теплоємність розчину NaCl за 0°С
У таблиці представлені значення масової питомої теплоємності водного розчину натрію хлористого NaCl різної концентрації при 0°С. Концентрація солі NaCl у розчині від 0,1 до 26,3%. За даними таблиці видно, що з підвищенням концентрації солі в розчині його теплоємність знижується.
Теплофізичні властивості розчину NaCl
У таблиці представлені теплофізичні властивості розчину хлористого натрію NaCl залежно від температури та концентрації солі. Концентрація хлориду натрію NaCl у розчині від 7 до 23,1 %. Слід зазначити, що з охолодженні водного розчину хлориду натрію його питома теплоємність змінюється слабко, теплопровідність знижується, а значення в'язкості розчину увеличивается.
Дані наступні теплофізичні властивості розчину NaCl:
- щільність розчину, кг/м 3;
- температура замерзання °З;
- питома (масова) теплоємність, кДж/(кг·град);
- коефіцієнт теплопровідності, Вт/(м·град);
- динамічна в'язкість розчину, Па·с;
- кінематична в'язкість розчину, м2/с;
- коефіцієнт температуропровідності, м2/с;
- число Прандтля.
Щільність розчинів натрію хлористого NaCl і кальцію CaCl 2 в залежності від концентрації при 15°С
У таблиці представлені значення густини розчинів хлористого натрію NaCl і кальцію CaCl 2 залежно від концентрації. Концентрація солі NaCl у розчині від 0,1 до 26,3 % за температури розчину 15°С. Концентрація хлориду кальцію CaCl 2 у розчині знаходиться в діапазоні від 0,1 до 37,3 % за його температури 15°С. Щільність розчинів хлориду натрію та кальцію зростає зі збільшенням вмісту в ньому солі.
Коефіцієнт об'ємного розширення розчинів хлористого натрію NaCl та кальцію CaCl 2
У таблиці наведено значення середнього коефіцієнта об'ємного розширення водних розчинів хлористого натрію NaCl і кальцію CaCl 2 залежно від концентрації та температури.
Коефіцієнт об'ємного розширення розчину солі NaCl вказаний за температури від -20 до 20°С.
Коефіцієнт об'ємного розширення розчину хлориду CaCl 2 представлений при температурі -30 до 20°С.
Джерела:
- Данилова Г. Н. та ін. Збірник завдань з процесів теплообміну в харчовій та холодильній промисловості. М: Харчова промисловість, 1976. - 240 с.
Морська вода, на відміну прісної, немає певної точки замерзання, але завжди нижче 0°С. Температура замерзання морської води залежить від її солоності: чим більша солоність, тим нижча температура замерзання. Так, за середньої для океану солоності 35 % вода замерзає при -1,9°С, а за солоності 40% - при -2,2°С. У Чорному морі, наприклад де солоність від 15 до 20%, лід з'являється при охолодженні води від -0,8 до -1,1°С.
Коли морська вода охолоне до температури замерзання відповідно до своєї солоності, починається утворення кристалів льоду (замерзання). При замерзанні солі, що містяться в морській воді, не входять до складу кристалів льоду, що утворився, так як температура замерзання сольового розчину значно нижче (наприклад, температура замерзання попареної солі -21°С) . Тому більша частина солей випадає в незамерзаючу підлідну воду, а деяка се кількість вмерзає в лід у вигляді дрібних крапель міцного розчину солей, що істотно впливають на фізико-хімічні та механічні властивості морського льоду. Чим нижче температура, при якій замерзає вода, тим більше крапель розсолу залишається в морському льоду і тим більше його солоність. Солі, що випадають у процесі замерзання морської води в поверхневий шар, збільшують його солоність, що знижує температуру замерзання.
Температура максимальної відносної щільності і температура замерзання морської води зі збільшенням солоності знижуються. При солоності 24,7% обидві температури стають однаковими: -1,33°С. Води, солоність яких менше 24,7 %, називаються солонуватими, температура їх найбільшої щільності вище за температуру замерзання. Тому процес замерзання води солоністю менше 24,7% відбувається так само, як і прісної води: спочатку вода досягає температури найбільшої густини при даній солоності, потім точки замерзання.
У води солоністю понад 24,7% температура найвищої щільності завжди нижче температури замерзання, тому до моменту замерзання щільність морської води зі зниженням температури збільшується, і верхні охолоджені шари води (як важчі) опускаються вниз; на поверхню піднімаються менш щільні та тепліші води, що ускладнює льодоутворення. У зв'язку з цим у морях та океанах пода замерзає лише після тривалих осінніх холодів, коли вся товща води, охоплена вертикальною циркуляцією (конвекцією), охолоне до температури замерзання.
Прісна вода має найбільшу щільність за +4°С і починає замерзати при 0°С. У прісноводному басейні після охолодження води до +4°С подальше охолодження її поверхневого шару відбувається дуже швидко. Вода тут стає легше нижчих вод, що виключає перемішування, отже, і підняття на поверхню тепліших водних мас із глибини. Лід, що утворився з прісної води, є однорідною масою крижаних кристалів, в яку вкраплені бульбашки повітря і різні тверді частинки, що знаходилися у воді.
Якщо ви помітили, то в морі вода замерзає при температурі значно нижче від нуля градусів. Чому так відбувається? Усе залежить від концентрації у ній солі. Чим її більше, тим нижча температура замерзання. У середньому збільшення солоності води на два проміле знижує температуру її замерзання на одну десяту градуса. Ось і посудіть самі, якою має бути температура навколишнього повітря, щоб на поверхні моря, із солоністю води 35 проміле, утворився тонкий шар льоду. Як мінімум, має бути два градуси морозу.
Те саме Азовське море, із солоністю води 12 проміле, замерзає при температурі мінус 0,6 градуса. При цьому Сиваш, що примикає до нього, залишається незамерзлим. Вся справа в тому, що солоність його води становить 100 проміле, а отже, для утворення тут льоду необхідно не менше шести градусів морозу. Щоб льодом покрилася поверхня Білого моря, де рівень солоності води досягає 25 проміле, потрібно, щоб температура знизилася до мінус 1,4 градуса.
Найдивовижніше в тому, що в охолодженій до мінус одного градуса морській воді сніг не таїть. Він просто продовжує в ній плавати, доки не перетвориться на шматок льоду. Але потрапляючи в охолоджену прісну воду, він відразу таїть.
Процес замерзання морської води має особливості. Спочатку починають формуватися первинні крижані кристали, які неймовірно схожі тонкі прозорі голки. Сіль у них відсутня. Вона вичавлюється з кристалів і залишається у воді. Якщо зібрати такі голки, і розтопити в якомусь посуді, то ми отримаємо прісну воду.
Каша з крижаних голок, зовні схожа на величезну жирну пляму, плаває на поверхні моря. Звідси та її оригінальна назва – сало. При подальшому зниженні температури сало змерзається, утворюючи гладку і прозору крижану кірку, що зветься нілас. На відміну від сала, нілас містить сіль. Вона з'являється в ньому в процесі змерзання сала та захоплення голками, крапель морської води. Це досить хаотичний процес. Саме тому сіль у морському льоді розподіляється нерівномірно, як правило, у вигляді окремих вкраплень.
Вчені з'ясували, що кількість солі в морському льоді залежить від температури навколишнього повітря, яка мала місце у момент його утворення. При невеликому морозі швидкість утворення ніласу низька, голки захоплюють мало морської води, звідси й солоність льоду невисока. При великому морозі ситуація прямо протилежна.
При таненні морського льоду з нього насамперед виходить сіль. В результаті він поступово стає прісним.